Академический редактор: Yi-huang Hsueh
Получено: 11 августа 2021 г.
Принято: 1 сентября 2021 г.
Опубликовано: 5 сентября 2021 г.
Примечание издателя: MDPI остается нейтральным в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Аннтоция: Hericium erinaceus (HE) (Ежовик гребенчатый) — крупный съедобный лекарственный гриб. В его мицелии содержится Эринацин А (ЭрА) представляющий собой вторичный метаболит гриба, к фармакологическим свойствам которого относят влияние на рост нервов центральной нервной системы. В этом исследовании для получения мицелиальной массы и ЭрА проводили культивирование гриба Hericium erinaceus в чашках Петри и стеклянных банках на твердом субстрате. На картофельно-декстрозном агаре (PDA) была получена наибольшая масса мицелия при температуре культивирования 25°C, но Эринацина А в агаровой среде обнаружено не было. При культивировании в стеклянных банках исследовали биомассу мицелия и удельный выход ЭрА варьируя вид субстрата, размеры частиц, вес субстрата, источники азота и неорганических солей. Эринацин А очищали через колонку с силикагелем и полупрепаративную ВЭЖХ (высокоэффективная жидкостная хроматография) и идентифицировали с помощью жидкостной хроматографии и масс-спектрометра. Наилучшие условия для культивирования Hericium erinaceus на твердом субстрате получились следующими: в качестве субстрата - зерна кукурузы, размер частиц - менее 2,38 мм с добавлением 10 мМ ZnSO4, 7H2O, биомасса мицелия - 50,24 мг сухой массы клеток/г субстрата. Удельный выход ЭрА мог достигать 165,36 мг/г сухой массы клеток.
Ключевые слова: Hericium erinaceus; Эринацин А; мицелиальная биомасса; культивирование на твердом субстрате; жидкая культура-мицелиальная культура; очистка
1. Введение
Гриб Hericium erinaceus (Ежовик гребенчатый), также называют львиной гривой, головой обезьяны, бородатым зубом или бородатым ежом, принадлежит к семейству Hericiaceae. В основном распространен в Азии, Европе и Северной Америке. Плодовое тело Ежовика гребенчатого в Китае веками считали, как съедобный и лекарственный гриб [1,2]. В настоящее время во многих исследованиях установлено, что плодовые тела и мицелий Ежовика гребенчатого содержат большое количество биоактивных соединений, таких как полисахариды [3,4], гериценоны [5], эринацины [6] и эрготионеин [7]. Сообщалось, что эти биологически активные соединения полезны для здоровья человека при различных физиологических заболеваниях, в том числе нервной системы, пищеварительной системы, системы кровообращения и иммунной системы [1,8-10]. Эринацины относятся к дитерпеноидам, своего рода вторичным метаболитам. Из мицелия Ежовика гребенчатого выделяли несколько эринацинов (например, Эринацины A-K, P и Q), среди которых было обнаружено, что Эринацин A (ЭрА) представляет собой особое соединение, способное стимулировать действие фактора роста нервов (NGF) [11,12]. К настоящему времени подтверждено, что ЭрА, обнаруженный в мицелии Ежовика гребенчатого, оказывает фармакологическое действие на центральную нервную систему [13], т.е. долгосрочную профилактику инсульта [14], болезни Паркинсона [15], болезни Альцгеймера [16], депрессия и заболевания, связанные с нервами, такие как диспареуния и пресбиакузис [17]. В исследованиях сообщалось, что все нейродегенеративные заболевания эффективно облегчались за счет поглощения родственных дитерпеноидов, таких как ЭрА [18].В литературе было доказано, что Ежовик гребенчатый способен продуцировать биологические метаболиты, как эринацины и гериценоны в погруженном культивировании или на твердом субстрате [19,20]. Культивирование на твердом субстрате особенно подходит для гифомецетных грибов, поскольку так можно имитировать естественную среду обитания культуры. Ключом для успешного культивирования на твердом субстрате является выбор субстрата. На культивирование на твердом субстрате влияет несколько факторов: размер частиц субстрата, pH субстрата, относительная влажность, добавки (источник азота, источник углерода или солей) [21,22]. Культивирование на твердом субстрате имеет несколько преимуществ, в том числе сложность загрязнения, низкую стоимость, высокую урожайность, низкое потребление энергии, низкое образование органических сточных вод, простоту удаления отходов и удобный источник питательной среды [23].
Существует несколько исследований, касающихся производства ЭрА из мицелия Ежовика гребенчатого погружным способом или на твердом субстрате. Кроме того, интересно, что эринацины, такие как ЭрА, можно обнаружить только в мицелиалии гриба, но не в плодовом теле [16,24]. Valu и др. разработали среду, состоящую из дрожжевого экстракта, глюкозы, соевого порошка и овса, и обнаружили, что в ней может быть увеличен выход общих фенольных соединений Ежовика гребенчатого; однако количественно содержание ЭрА обнаружено не было [6]. Krzyczkowski и др. разработали среду, содержащую как глюкозу, так и казеин, для достижения большой биомассы мицелия Ежовика гребенчатого с выделением ЭрА на 8-й день [25]. Chang и др. изменяли состав прежней среды для повышения биомассы Ежовика гребенчатого и выхода эринацинов [26]. Gerbec и др. сообщали, что при культивировании Ежовика гребенчатого на твердом субстрате в стеклянной банке мицелиальная биомасса гриба может произвести некоторое количество ЭрА; однако в горизонтальном реакторе с мешалкой и аэрацией в мицелии было обнаружено более высокое содержание биомассы, но не содержание ЭрА [27].
В других культурах ежовика гребенчатого на твердом субстрате было отмечено, что обычные субстраты, используемые для выращивания гриба, состоящие из древесной щепы, способствовали образованию плодового тела Ежовика гребенчатого и продукции внеклеточных ферментов; однако содержание ЭрА обнаружено не было [27,28]. В настоящее время мало литературы, посвященной получению ЭрА из мицелия Ежовика гребенчатого при культивировании в твердых субстратах. Это первое исследование, посвященное использованию культивирования мицелия Ежовика гребенчатого на твердом субстрате для повышения удельного выхода ЭрА.
В этом исследовании при получении ЭрА из мицелия Ежовика гребенчатого изучалось культивирование мицелия на твердом субстрате как в чашках Петри, так и в стеклянных сосудах. Мы исследовали влияние различных сред и температур в чашках Петри на рост мицелия гриба. При культивировании Ежовика гребенчатого были проанализированы шесть разных типов зерна. Было исследовано влияние размера частиц субстрата, источников азота и добавок либо NaCl, либо ZnSO4 на выход ЭрА. В исследовании измеряли биомассу мицелия гриба и удельный выход ЭрА. Были выбраны методы очистки и анализа для количественного определения концентрации ЭрА. Факторы, которые, как ожидается, будут способствовать продукции ЭрА при культивировании на твердом субстрате, анализировались количественно.
2. Материалы и методики
2.1. Субстрат и добавки
Штамм H. erinaceus MU30296 был приобретен в Центре сохранения и исследований биологических ресурсов Научно-исследовательского института пищевой промышленности, Синьчжу, Тайвань. Для культивации использовался картофельно-декстрозный агар, экстракт солода и экстракт дрожжей, приобретенные у Becton, Dickinson and Company, США. Шлифованный рис, кукурузные зерна, зерна бусенника, бурый рис, красная фасоль и кунжут куплены в местных супермаркетах. Остальные реагенты аналитической чистоты - получены от местных поставщиков.2.2. Условия культивации
Для культивирования на чашках Петри с чашки прекультуры вырезали кусок мицелия Ежовика гребенчатого площадью 0,25 см2 и переносили на чашку Петри, в которой проводилось исследование. Состав агара на чашке был следующим: агар с экстрактом солода (MA) (г/л): глюкоза 18,9, экстракт солода 18,9, пептон 0,9, агар 15,0; агар с дрожжевым экстрактом (YE) (г/л): дрожжевой экстракт 3,0, пептон 5,0 и агар 15,0, и картофельно-декстрозный агар (г/л): глюкоза 20, картофельный крахмал (настой из 200 г картофеля) 4,0, агар 15,0 [29]. Культивирование в чашке проводилось в инкубаторе при 25°С в течение 10–15 дней. Чтобы подготовить посевную культуру для культивации на твердом субстрате, вырезали 3 кусочка мицелия площадью 4 см2, выращенные на картофельно-декстрозном агаре (PDA) в течение 10 дней, и слегка гомогенизировали в стерильной бутылке с остроконечным краем, содержащей 40 мл дистиллированной воды, в течение 1 с, 8 раз для получения однородной суспензии мицелия.Гомогенизированную смесь объемом 10 мл вводили в 100 мл посевной среды, содержащей (г/л): глюкоза 4, пептон 1, дрожжевой экстракт 0.2, MgSO4-7H2O 0.1, KH2PO4 0.05. Культивирование проводили в роторном инкубаторе при 25°С, 100 об/мин в течение 7 суток. Подготовленную посевную культуру использовали для инокуляции твердого субстрата в банке (F 12 см), содержащую различные сухие твердые зерна: шлифованный рис, зерна кукурузы, зерна бусейника, бурый рис, красную фасоль и кунжут. Твердую среду готовили из 50 г зерен, смешанных с 50 мл деионизированной (ДИ) воды, с последующей стерилизацией при 121°С в течение 20 мин. Соотношение объема инокулята и массы зерен в твердых средах - 1/5. Культивирование проводили в инкубаторе при температуре 25°С в течение 20 дней. При контроле на массу зерна отношение зерна к воде (масса/объем) поддерживалось на уровне 1:1. Для проведения исследований по размеру частиц зерна кукурузы измельчали в порошок в блендере, после чего просеивали через два сита: mesh5 и mesh8, для получения трех различных грансоставов: крупные частицы (> 4 мм), средние частицы (2,38-4 мм) и мелкие частицы (<2,38 мм). При исследовании добавок использовались 0,25-1,5г казеина, 0,25-1,5 г триптона и 1 мл исследуемых добавок (10-40мМ NaCl, 10-40мМ ZnSO4-7H2O), которые добавляли в банку к 50г зерна и 50мл деионизированной воды.
При погруженном культивировании вышеупомянутую посевную культуру инокулировали (объемное соотношение 1/10) в стерильную жидкую среду, содержащую (г/л): глюкоза - 70, NH4NO3 - 8, NaCl - 1,45, ZnSO4-7H2O - 0,055 и KH2PO4 - 1. [25].
Культивирование проводили во встряхивающем инкубаторе при 25°С и 100 об/мин в течение 20 дней. Состав среды и условия культивирования погруженной культуры были выбраны из оптимальных условий, определенных в предварительных исследованиях.
2.3. Очистка Эринацина А
В качестве стандарта был принят и модифицирован подход Krzyczkowski и др. [25] для самостоятельного очищения Эринацина А. Собранный мицелий высушивали и растирали в порошок в ступке, затем 1 г порошка добавляли к 75 мл 95%-ного этанола и экстрагировали при ультразвуковом встряхивании в течение 1 часа. Экстракт центрифугировали при 9000 g в течение 10 мин, пропускали через фильтр 0,22 мкм и концентрировали в вакууме. Экстракт повторно растворяли в 8 мл этилацетата с последующим добавлением 2 мл деионизированной воды и перемешивали в ультразвуковой ванне в течение 20 мин. Слой этилацетата промывали 5% раствором хлорида натрия. Слой этилацетата отделяли, пропускали через дисковый фильтр с размером пор 0,22 мкм и оставляли в сушильном шкафу при 50°С в течение ночи. После сушки экстракт повторно растворяли в 95% этаноле (0,2 г твердого вещества плюс 1 мл этанола), пропускали через дисковый фильтр 0,22 мкм и вводили в колонку с силикагелем. В качестве подвижной фазы использовали растворитель этилацетат и н-гексан (1:1) со скоростью потока 5 мл/мин. Элюированный растворитель собирали в пробирки по одной пробе в минуту. Собранные образцы высушивали в печи при 50 °C с последующим добавлением 1 мл этанола для повторного растворения образца. Отбирали образец на 25-й минуте с самым высоким поглощением при 340 нм. Собранный образец далее подвергали полупрепаративной ВЭЖХ(жидкостная хроматография высокого давления), как вкратце описано ниже. Образец (0,1 г) растворяли в 1 мл метанола и перемешивали в течение 1 ч в ультразвуковой ванне. Экстракт центрифугировали при 7000 g в течение 10 мин. Супернатант пропускали через дисковый фильтр 0,22 мкм и подвергали полупрепаративной высокоэффективной жидкостной хроматографии. Использовалась колонка Inspire C18, 5 мкм (250 мм х 10,0 мм), детектор: УФ 340 нм, скорость потока: 3,0 мл/мин, подвижная фаза: 80% метанол, ввод пробы 200 мкл. Образец при 23,583 мин на пике поглощения (длина волны: 340 нм) собирали и сушили в печи при 50°С в течение ночи. Для идентификации полученный кристалл подвергали жидкостной хроматографии-тандемной масс-спектрометрии (TSQ Altis, Thermo Scientific, Waltham, MA, USA) с ионизацией электрораспылением (ESI) [27].2.4. Анализ
Для определения сухой клеточной биомассы в погруженной культуре всю культуральную среду собирали и дважды промывали деионизированной водой с последующей сушкой в сушильном шкафу при температуре 50°C в течение 5 дней. Рост мицелия в чашке Петри оценивали по изображению области, покрытой мицелием, и преобразовывали его в гидравлический радиус (мм) = квадратный корень из (площадь покрытия биомассой/π) с помощью программного обеспечения ImageJ (Национальные институты здравоохранения, Гамильтон, МТ, США). Для определения биомассы в культуре на твердом субстрате, собранный субстрат подвергали анализу на содержание в нем эргостерола через жидкостную хроматографию высокого давления [30]. Строили линейную корреляцию между биомассой Ежовика гребенчатого (мг клеток сухого веса/г субстрата) и содержанием эргостерола. Вкратце эргостериновый анализ можно описать следующим образом: 1 г измельченного сухого субстрата подвергали экстракции в 12 мл н-гексана с последующим перемешиванием в вортексе в течение 90с и центрифугированием при 7000g в течение 10 мин с получением надосадочной жидкости. Супернатант подвергали вакуумной сушке при 40°С с последующим растворением в 5 мл метанола и пропускали через дисковый фильтр 0,22 мкм. Собранный образец анализировали с помощью жидкостной хроматографии высокого давления (колонка: SCpak, 5 мкм C18, 250 мм × 4,6 мм), детектор (Jusco: UV-1575): УФ 282 нм, скорость потока: 1,2 мл/мин, подвижная фаза: метанол, температура колонки: 40 ◦C, объем ввода: 20 мкл.Для определения Эринацина А 1 г измельченного субстрата экстрагировали в 10 мл метанола. Смесь оставляли для перемешивания ультразвуком в течение 3 мин и центрифугирования при 7000g в течение 10 мин. Супернатант фильтровали через дисковый фильтр 0,22 мкм и анализировали с помощью ВЭЖХ (колонка: SCpak, 5 мкм C18, 250 × 4,6 мм), детектор (Jusco: UV-1575): 340 нм, подвижная фаза: 80% метанол, поток скорость: 1,0 мл/мин, температура колонки: 25 ◦C, вводимый объем: 10 мкл. Супернатант пропускали через дисковый фильтр 0,22 мкм и анализировали с помощью жидкостной хроматографии высокого давления (колонка: SCpak, 5 мкм C18, 250 × 4,6 мм), детектор (Jusco: UV-1575): 340 нм, подвижная фаза: 80% метанол, поток скорость: 1,0 мл/мин, температура колонки: 25 ◦C, вводимый объем: 10 мкл. Удельный выход ЭрА определяли как отношение ЭрА к сухой массы клеток (мг/г).
2.5. Статистический анализ
Все эксперименты были выполнены в трехкратной повторности; данные выражены как среднее ± стандартное отклонение. Статистическую значимость оценивали через апостериорный дисперсионный анализ множественных сравнений Тьюки (ANOVA) с использованием OriginPro версии 9.0 (OriginLab Corporation, Нортгемптон, Массачусетс, США). Различия результатов считались статистически значимыми при значениях p < 0,05 или значениях p < 0,01.3. Обсуждение результатов
3.1 Культивирование Ежовика гребенчатого на твердом субстрате в чашке Петри
3.1.1 Эффект среды на рост мицелияДля наблюдения за ростом мицелия и оптимальной температуры культивирования были приготовлены три среды PDA, MA и YE. Культивирование проводили в течение 30 суток, скорость роста мицелия регистрировали каждые 5 суток. Схемы роста HS мицелия показаны на рисунке 1. График времени роста мицелия представлена гидравлическим радиусом на рисунке 2а. Мицелий Ежовика гребенчатого на чашке PDA быстро рос на 5-й день и занял всю чашки на 20-й день, где гидравлический радиус составлял 38,1 мм (радиус чашки Петри 42,5 мм). Через 20 суток рост гриба вошел в стационарную фазу так как чашка с PDA была заполнена мицелием; цвет мицелия изменился с белого на светло-желтый. Для сравнения, рост Ежовика гребенчатого в чашках с экстрактом солода (MA) и дрожжевым экстрактом (YE) был намного медленнее, чем в чашках с картофельно-декстрозным агаром (PDA), на 5-й и 10-й день, а мицелий HS явно не наблюдался до 15-го дня. Мицелий Ежовика гребенчатого на 30-й день имел гидравлический радиус 35,59 мм на чашке Петри с MA и 23,40 мм на чашке с YE. Вероятно, в YE мицелию не хватало источников углерода, что вызывало медленный или плохой рост. Напротив, мицелий на PDA показывает самую высокую скорость роста так как среда содержит 20 г/л декстрозы плюс 200 г/л картофельного настоя, который обеспечивает достаточный уровень углерода для роста Ежовика гребенчатого. Чтобы проверить производство Эринацина А мицелием, шесть пластин из чашек с PDA от b-1 до b-6 (См. рисунок 1) сушили в печи для извлечения ЭрА из мицелия гриба, но содержание ЭрА не было обнаружено. Это может быть связано с недостаточным ростом мицелия Ежовика гребенчатого в ограниченном пространстве или ингибированием ЭрА при культивировании на чашке Петри.

Рисунок 1. Характер роста мицелия HS на чашке Петри. Используемые среды: (а) агаровая среда с солодовым экстрактом (МА), (б) агаровая среда с картофельной декстрозой (PDA) и (в) агаровая среда с дрожжевым экстрактом (YE).

3.1.2. Влияние температуры на рост мицелия
Чтобы установить оптимальную температуру роста гриба, чашки PDA с инокулятом Ежовика гребенчатого культивировали при разных температурах в течение 30 дней. Результаты приведены на рисунке 2b. Оптимальная температура для роста мицелия составляла 25 ◦C, что согласуется с выводами Boddy и др. [31] и Ко и др. [32]. Мицелий Ежовика гребенчатого при 25 ◦C демонстрировал быстрый рост на 5-й день и заполнил всю чашку Петри на 20-й день. Напротив, мицелий рос медленнее при температурах 15 или 30 ◦C. С другой стороны, мицелий Ежовика гребенчатого продвигался наиболее медленно при 30 ◦C, и окраска мицелия была темнее, чем при других температурах. Стоит отметить, что при температуре 15 ◦C, гриб образует компактную и жесткую примордию (рис. 3). Примордия – переходная структура превращения мицелия в плодовые тела. Согласно измерениям Corana [33], ЭрА в примордии не обнаружен.

Рисунок 3. Образование примордий в чешке Петри с агаром PDA при температуре 15°С.
3.2. Культивация Ежовика гребенчатого на твердом субстрате в банке
3.2.1 Влияние субстрата на культивацию мицелия Ежовика гребенчатогоПреимущество культивирования на твердом субстрате заключается в удобности источника субстрата, подойдут, например, агропищевые отходы или натуральные пищевые культуры [3]. Поскольку цельное зерно можно легко и недорого купить, в качестве субстрата были выбраны шесть различных видов зерна: шлифованный рис, кукурузные зерна, зерна бусенника, бурый рис, красная фасоль и кунжут. Состав зерен указан в таблице 1. Культивирование Ежовика гребенчатого на твердом субстрате проводили в стеклянной банке при 50%-ном содержании воды в течение 20 суток. Результаты приведены на Рисунке 4. На зернах кукурузы наблюдался самый высокий урововень мицелиальной биомассы, достигавший 63,73 мг сухого веса/г субстрата по сравнению с другими субстратами, и имеет относительно высокий удельный выход ЭрА 12,53 мг/г сухого веса (или 0,798 мг/г субстрата), поскольку Зерно кукурузы было более пушистым и мягким, и готовым к росту мицелия Ежовика гребенчатого, так как быстрое увеличение мицелия гриба наблюдалось на ранней стадии культивирования. Напротив, биомасса мицелия на шлифованном рисе, зернах бусенника, бурого риса и красной фасоли составляли 39,12 мг/г, 21,39 мг/г, 62,15 мг/г и 23,07 мг/г соответственно. Результаты показали, что высокое содержание углеводов увеличивает биомассу мицелия, а высокое содержание липидов снижает биомассу мицелия. Поскольку кунжут богат маслами, мицелию Ежовика гребенчатого было нелегко расти на его поверхности, а количество биомассы и ЭрА было слишком низким, чтобы его можно было обнаружить. С другой стороны, удельные выходы ЭрА составляли 13,43 мг/г, 12,01 мг/г, 3,69 мг/г и 6,06 мг/г для шлифованного риса, зерен бусенника, бурого риса и красной фасоли соответственно. Результаты показывают, что более низкое отношение углерода к азоту (C/N) неблагоприятно сказывается производства ЭрА. Сообщалось, что для биосинтеза ЭрА в мицелии Ежовика гребенчатого подходит отношение C/N от 6 до 10 [13]. Принимая во внимание как производство биомассы, так и удельный выход ЭрА, культивирование Ежовика гребенчатого на кукурузном зерне в качестве субстрата дает наибольший выход ЭрА. Поэтому в качестве субстрата для следующих экспериментов было выбрано зерно кукурузы.
Таблица 1. Состав и отношение углеводов к азоту (C/N) в данном исследовании
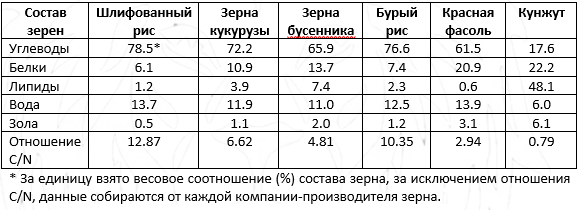

Рисунок 4. Влияние субстратов на биомассу мицелия и удельный выход ЭрА. I. шлифованный рис, II. кукурузное зерно III. зерна бусенника, IV. бурый рис, V. красная фасоль, VI. кунжут. Разные верхние индексы в верхнем регистре указывают на достоверное отклонение (p < 0,05) по биомассе, а разные верхние индексы в нижнем регистре указывают на достоверное отклонение (p < 0,05) в удельном выходе ЭрА.
3.2.2 Влияние размера частиц
Чтобы увеличить производство мицелиальной биомассы и удельный выход ЭрА, было изучено несколько факторов, влияющих на ферментацию на твердом субстрате. В целом размер частиц субстрата при культивировании в твердом состоянии влиял на производство мицелиальной биомассы и ферментированного продукта. Порошок кукурузных зерен разделили на частицы трех размеров просеиванием через два сита. Влияние размера частиц субстрата можно увидеть на рисунке 5а. Мицелиальная биомасса на крупных (>4 мм), средних (2,38–4 мм) и мелких (<2,38 мм) частицах составила 37,54 мг/г, 45,88 мг/г и 57,25 мг/г соответственно. Размер частиц субстрата не оказывал существенного влияния на продукцию мицелиальной биомассы. Однако удельный выход ЭрА резко увеличивался с уменьшением размера частиц с 12,53 мг/г (>4 мм) до 60,15 мг/г (<2,38 мм). Удельный выход ЭрА на мелких частицах был в 4,8 раза больше, чем на крупных. Membrillo и др. производил лигноцеллюлозолитические ферменты из Pleurotus ostreatus; наибольшая ксиланазная, целлюлазная и лакказная активность получались при размерах частиц субстрата 2,9 мм, 0,92 мм, 1,68 мм соответственно [36]. Smail и др. культивировали Aspergihs niger в на твердом субстрате и обнаружили, что размер частиц стручков рожкового дерева 2,5 мм дает самое высокое содержание белка в конечном продукте [37]. В нашем случае более мелкие частицы показывали высокий удельный выход ЭрА, возможно, из-за более плотной упаковки, что привело к ограниченной доступности O2, что, в свою очередь, увеличило производство вторичных метаболитов ЭрА.
3.2.3 Влияние массы субстрата
Поскольку мицелий на поверхности субстрата образовывал мицелиальный мат, циркуляция воздуха уменьшалась, что приводило к ограничению доступности O2 на дне. Таким образом, ожидалось, что увеличение количества субстрата в стеклянной банке увеличит объем пространств с анаэробными условиями [38]. Для исследования влияния толщины слоя субстрата проводили эксперименты в стеклянной банке, содержащей различное количество субстрата. Поскольку нижняя часть стеклянной банки имеет цилиндрическую форму, вес субстрата пропорционален толщине в стеклянной банке, где 150 г субстрата эквивалентны высоте 4,5 см. Результаты показаны на рисунке 5b. При увеличении массы субстрата с 50 г до 150 г биомасса мицелия снижалась с 56,79 мг/г до 31,52 мг/г. Результаты показали, что увеличение количества субстрата не способствует увеличению биомассы мицелия Ежовика гребенчатого на массу субстрата. Причина, вероятно, в том, что при увеличении веса субстрата увеличивается толщина слоя субстрата, поэтому снижается содержание кислорода на дне, что приводит к плохому росту мицелия. Stredansky и др. сообщали, что при толщине субстрата выше 6 см, выход сукциногликана из Agrobacterium tumefaciens резко снижался [39]. Rhizopus oryzae, выращенный на хлебных отходах, обладают максимальной протеазной и амилазной активностью при толщине слоя 1 см [40]. Кроме того, наибольший удельный выход ЭрА был зафиксирован в случае с 50 г субстрата. После 20 суток культивирования отмечали, что в случае с 50 г субстрата мицелий занимал все дно банки, в то время как в других случаях оно было не полностью покрыто мицелием, вероятно, из-за недостаточного доступа кислорода.
3.2.4 Влияние источников азота и неорганической соли
Источник азота среды при погружной ферментации оказывает значительное влияние на рост мицелия Ежовика гребенчатого и продукцию ЭрА [25]. Поэтому при культивировании на твердом субстрате для увеличения биомассы мицелия и продукции ЭрА к субстрату добавляли казеин и триптон. Эффект от добавления источника азота представлен на рисунке 6a,b. Cамый высокий уровень биомассы мицелия 80,56 мг/г (рис. 6b) был получен при добавлении 5 мг триптонана 1г субстрата, но биомасса мицелия уменьшалась, когда добавление казеина или триптона превышало 5 г/г субстрата. Это согласуется с выводами о том, что низкое отношение C/N неблагоприятно для роста клеток мицелия [13]. С другой стороны, удельный выход ЭрА не повышался при добавлении казеина или триптона. Сообщалось, что добавление неорганических солей к субстрату увеличивает производство растворимых пищевых волокон при культивировании Ежовика гребенчатого на твердом субстрате [41]. Поэтому в субстрат добавляли NaCl и ZnSO4·7H2O. Эффект добавления NaCl показан на рисунке 6c. Удельный выход ЭрА был значительно выше при низких концентрациях NaCl 10 мМ и 20 мМ. Удельный выход ЭрА составил 120,97 мг/г при концентрации NaCl 10 мМ, что в 2 раза выше, чем в контрольном образце. С другой стороны, самый уровень биомассы мицелия составил 87,38 мг/г при концентрации NaCl 40 мМ, что в 1,5 раза выше, чем в контрольном образце, но удельный выход ЭрА был очень низким. Добавление ионов цинка дополнительный источник микроэлементов для роста плодовых тел [42]. Lin и др. сообщили, что следы ZnSO4 увеличивают продукцию сульфатированных полисахаридов в Antrodia cinnamomea [43]. Влияние от добавления ZnSO4·7H2O показан на рис. 6d. Наибольший удельный выход ЭрА составлял 165,36 мг/г при концентрации ZnSO4·7H2O 10 мМ, что в 2,73 раза выше, чем в контрольном образце. Результаты показывают, что соответствующее добавление NaCl или ZnSO4·7H2O может помочь увеличить производство мицелиальной биомассы или ЭрА.

Рисунок 6. Влияние добавок (а) казеина, (б) триптона, (в) NaCl и (г) ZnSO4·7H2O на рост мицелия и производство ЭрА. *, ** указывают на достоверное различие биомассы с контрольным образцом при p < 0,05 и p < 0,01 соответственно. +, ++ указывают значения ЭрА разница с контрольным образцом при р < 0,05 и р < 0,01 соответственно.
3.3 Очистка ЭрА и идетификация
Для очистки ЭрА, в качестве стандарта для количественного анализа использовали самонабивную колонку с силикагелем и метод полупрепаративной жидкостная хроматография высокого давления, описанный в разделе 2.3. Очищенный ЭрА подвергали жидкостной хроматографии-тандемной масс-спектрометрии (ЖХ/МС/МС, модель TSQ Altis, Thermo Scientific, Массачусетс, США). Масс-спектр ионизации электроспреем(ESI) у ЭрА (рис. 7a) показал м/з(масса/заряд) 455,3 для [ErA+Na]+, что согласуется с данными из литературы [27,33]. Для дальнейшего подтверждения результата соединение было отправлено на тандемный масс-анализ; основной фрагмент ЭрА был получен при м/з 323,2 (рис. 7b). Для количественного анализа ЭрА использовали метод жидкостной хроматографии высокого давления, описанный в разделе 2.4. Профиль жидкостной хроматографии высокого давления из мицелиального экстракта Ежовика гребенчатого показан на рисунке 7c; Пик поглощения ЭрА был зарегистрирован на 14,15 мин детектором UV/Vis при длине волны 340нм.


3.4. Сравнение производства ЭрА в погружной ферментации и при культивировании на твердом субстрате
Существующая литература, посвященная производству ЭрА, приведена в таблице 2. Сообщалось, что самый высокий удельный выход ЭрА при культивировании Ежовика гребенчатого в погружном состоянии в течение 8 дней составляет 14,44 мг/г и 13,39 мг/г [25,26]. Удельный выход ЭрА, производимого ферментационным резервуаром, составляет 5 (мг/г) [17,44]. Gerbec и др. культивировали Ежовика гребенчатого на твердом субстрате в стеклянной банке для получения ЭрА, и было зарегистрировано 225,4Х103 (площадь под кривой, AUC) из-за отсутствия эталона ЭрА [27]. В нашей лаборатории погружная ферментация проводилась при встряхивании с использованием среды на основе глюкозы (раздел 2.2) для производства ЭрА из мицелия Ежовика гребенчатого. После 12 дней погружной ферментации самая высокая продукция ЭрА 56,8 мг/л была получена при биомассе мицелия 4,42 г сухого веса/л (эквивалентно удельному выходу 12,85 мг/г сухого веса). В этом исследовании для культивирования Ежовика гребенчатого использовались чашка Петри и стеклянная банка, но выход ЭрА был только в стеклянной банке. После выбора зерен кукурузы в качестве субстрата и измельчения субстрата до мелкого размера удельный выход ЭрА был увеличен с 12,53 мг/г сухого веса до 60,15 мг/г сухого веса. Отмечено, что культивирование на твердом субстрате имеет более высокий удельный выход ЭрА, чем при погружной ферментации. При добавлении неорганических солей может сильно увеличиться производство мицелиальной биомассы или ЭрА. В случае добавления 10 мМ ZnSO4·7H2O удельный выход ЭрА значительно увеличивался до 165,36 мг/г сухой массы при биомассе мицелия 50,24 мг сухой массы/г субстрата.Таблица 2. Сравнение производства ЭрА, приведенных в литературе.

4. Заключение
Это исследование направлено на культивирование Ежовика гребенчатого на твердом субстрате для производства ЭрА. Ежовик гребенчатый культивировали в чашках Петри и стеклянных банках. ЭрА был обнаружен только при культивации в стеклянной банке. В качестве субстратов при культивировании на твердом субстрате использовали шесть различных субстратов; зерно кукурузы имело наибольшую биомассу мицелия 63,73 мг/г с удельным выходом ЭрА 12,53 мг/г. Размер частиц в меньшей степени влиял на массу мицелия, но уменьшение размера субстрата значительно увеличивало удельный выход ЭрА. Субстрат с малым размером частиц уменьшал доступ воздуха, так что ЭрА был менее склонен к деградации в условиях недостатка кислорода, что помогло увеличить удельный выход ЭрА. Добавление к субстрату соответствующих источников азота или неорганических солей может увеличить биомассу мицелия и удельный выход ErA; добавление NaCl или ZnSO4 приводило к значительному увеличению удельного выхода ЭрА до 120,97 мг/г и 165,36 мг/г соответственно. Кроме того, в этом исследовании был предложен метод очистки и анализа ЭрА. По сравнению с погружным культивированием, культивировании на твердом субстрате можно эффективно увеличить удельный выход ЭрА в 12,9 раза. Результаты этого исследования предоставляют информацию для увеличения масштабов культивирования Ежовика гребенчатого на твердом субстрате для производства ЭрА.Вклад автора: Концептуализация, Y.-C.L.; методология, P.-Y.C. и H.-Y.L.; формальный анализ, P.-Y.C.; исследование , P.-Y.C.; написание - подготовка первоначального проекта, C.-H.K. и Y.-C.L.; написание - обзор и редактирование, C.-H.K. и Y.-C.L. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование: это исследование финансировалось Министерством науки и технологий Тайваня (грант № MOST 108-2221-E-005-041-MY2).
Заявление Институционального контрольного совета: неприменимо.
Заявление об информированном согласии: неприменимо.
Заявление о доступности данных: неприменимо.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.